Indice Anterior Siguiente
Revista de Ciencias Médicas La Habana 2012; 18 (2)
Jorge Pérez Machado,1 Alejandro Eliécer Lie Concepción2
1Licenciado en Enfermería. Especialista de I grado en Embriología. Profesor Auxiliar e Investigador Agregado. Máster en Atención Integral a la Mujer y Educación Médica Superior. Facultad de Ciencias Médicas Mayabeque. Güines. Cuba.
2Licenciado en Enfermería. Profesor Auxiliar e Investigador Agregado. Máster en Urgencias Médicas. Facultad de Ciencias Médicas Mayabeque. Güines. Cuba.
La apoptosis es un proceso en el que aparecen múltiples eventos en diferentes momentos. Esto puede ser activado por diferentes estímulos, tales como: el daño al ADN, citocinas, pérdida de la matriz extracelular, etc. La detección de apoptosis ha adquirido gran importancia en el área del cáncer, ya que puede ser útil para conocer el mecanismo de acción de fármacos, mecanismos asociados a la naturaleza de la enfermedad, efectividad de tratamientos, etc. Debido a que la apoptosis es un proceso dinámico, la aparición de los eventos relacionados y su detección van a depender de múltiples factores. Dentro de los procesos comúnmente utilizados para detectar apoptosis está la detección de degradación de ADN, cambios en la simetría de la membrana celular y activación de proteínas específicas. El propósito de este artículo es describir los diferentes mecanismos por el cual se lleva a cabo este proceso, así como las principales funciones de la apoptosis como mecanismo homeostático de los organismos teniendo en cuenta el comienzo desde el punto de vista embriológico y la relación que se establece con las diferentes patologías clínicas. Es por ello que se decidió realizar una revisión actualizada, utilizando para la búsqueda de información las bases de datos disponibles en Infomed, así como la literatura presente en la biblioteca de los Policlínicos Docentes Universitarios “Marta Martínez Figuera” y “Luis Li Trigent”, del municipio Güines, en la provincia Mayabeque.
Palabras clave: apoptosis.
Apoptosis is a process whereby multiple events occur at different times. This can be activated by different stimuli, such as DNA damage, cytokines, extracellular matrix loss, etc. Detection of apoptosis has acquired great importance in the cancer area because it can be useful to understand the mechanism of drug action, mechanisms associated with the nature of the disease, effectiveness of treatments, etc.. Because apoptosis is a dynamic process, the occurrence of the events and detection will depend on multiple factors. Within the processes commonly used to detect apoptosis is the detection of DNA degradation, changes in the symmetry of the cell membrane and activation of specific proteins. The purpose of this article is to describe the various mechanisms by which this process is carried out, as well as the main functions of apoptosis as the homeostatic mechanism of organisms considering the start from the embryological standpoint and the relationship set with different clinical pathologies. That is why it was decided to make an updated review, using for the information search the databases in Infomed and present literature available in the libraries of "Marta Martínez Figuera" and "Luis Li Trigent" University Teaching Polyclinics of Güines' municipality.
Key words: apoptosis.
Durante el proceso del desarrollo embrionario de un organismo o durante los procesos encaminados a mantener la homeostasis de éste, es necesario eliminar células no deseadas. Este proceso se denomina muerte celular programada o apoptosis.
La apoptosis o "muerte celular programada" es una forma de suicidio celular genéticamente definida, que ocurre de manera fisiológica durante la morfogénesis, la renovación tisular y en la regulación del sistema inmunitario. Determinados hechos celulares pueden ser explicados por trastornos en la regulación de los genes responsables de la apoptosis, como es el caso de la transformación y la progresión tumorales. En este trabajo se revisaron las características fundamentales de este mecanismo de muerte celular, sus variaciones morfológicas, bioquímicas, los genes involucrados y su papel en el desarrollo de malignidades, entre otros aspectos de interés.1
La apoptosis, o muerte celular programada, es un proceso celular genéticamente controlado por el que las células inducen su propia muerte en respuesta a determinados estímulos. De ahí que frecuentemente se describa el proceso apoptótico como "suicidio celular" a la hora de definirlo conceptualmente.
La metaforización "suicidio celular" es doblemente significativa si se considera que la muerte celular programada es un proceso irreversible, al menos durante sus etapas iniciales. Conceptualmente la apoptosis puede ser considerada opuesta a la muerte celular por necrosis, en la que las células son sujetos pasivos irremediablemente abocados a morir. En este sentido, lo distintivo de la apoptosis radica en el control que ejercen las células sobre su propio destino, cuando "deciden" seguir el camino apoptótico.
En condiciones normales la apoptosis constituye un mecanismo fundamental para el mantenimiento de la homeostasis del organismo. Por ejemplo: como respuesta frente a la agresión que supone la entrada de un microorganismo, las células encargadas de la defensa del organismo, las células del sistema inmune, son activadas. Dicha activación supondrá, entre otras cosas, la proliferación de aquellas células del sistema inmune capaces de detener de forma específica dicha agresión. Como resultado, buena parte de estas células, que en su momento eran necesarias, dejan entonces de serlo, iniciando muchas de ellas el proceso de muerte celular programada, en este caso inducido por la ausencia del estímulo agresor. En otras palabras, cuando una infección es controlada, gran parte de las células del sistema inmune que contribuyeron a impedir dicha infección, dejan de ser necesarias, siendo eliminado el excedente celular generado por apoptosis.2
La apoptosis puede tener dos motivos fundamentales, como parte del desarrollo de estructuras corporales o bien para eliminar células que supongan una amenaza para la integridad del organismo. Se caracteriza por hipereosinofilia y retracción citoplasmática con fragmentación nuclear (cariorrexis), desencadenada por señales celulares controladas genéticamente. Estas señales pueden originarse en la célula misma o de la interacción con otras células.3
La apoptosis es un fenómeno biológico fundamental, permanente, dinámico e interactivo. Existen mecanismos pro o anti-apoptóticos, regulados genéticamente, que actúan de forma activa (pues consumen energía) y equilibrada. Como función necesaria para evitar la sobreproducción celular se sospechaba de su existencia, pero es un proceso ordenado y "silencioso" que no produce reacción tisular y por ello difícil de captar.
La apoptosis puede estar frenada, en equilibrio o estimulada. Por ejemplo, está frenada durante el desarrollo de espermatogonias, en las criptas de las glándulas intestinales (que es un epitelio de crecimiento rápido) y durante la lactancia en su período preparatorio, en que el tejido mamario aumenta su masa celular. Está en equilibrio respecto de la mitosis en los tejidos adultos sanos. Es muy significativo su rol homeostático en la médula ósea, donde debe destruir de manera constante la mitad de una inmensa cantidad de células que sólo en leucocitos significa 5 x 1011 cada 24 horas. Está estimulada cuando existen células envejecidas, mutadas, neoplásicas o no neoplásicas, alteradas por tóxicos y las que están en proceso de metamorfosis o atresia. Se ha estudiado esta condición en neutrófilos envejecidos, en megacariocitos con citoplasma agotado por producción excesiva de plaquetas, en la atresia folicular del ovario, en folículos pilosos en evolución y en la mama durante la involución post-lactancia.4
La muerte celular programada es parte integral del desarrollo de los tejidos tanto de plantas (viridiplantae) como de animales pluricelulares (metazoa). En animales, la forma de muerte celular programada más corriente es la "apoptosis". Cuando una célula muere por apoptosis, empaqueta su contenido citoplasmático, lo que evita que se produzca la respuesta inflamatoria característica de la muerte accidental o necrosis. En lugar de hincharse y estallar y, por lo tanto, derramar su contenido intracelular dañino enzimático, hacia el espacio intercelular, las células en proceso de apoptosis y sus núcleos se encogen, y con frecuencia se fragmentan conformando vesículas pequeñas que contienen el material citoplasmático. De esta manera, pueden ser eficientemente englobadas vía fagocitosis y, consecuentemente, sus componentes son reutilizados por macrófagos o por células del tejido adyacente.
Dos formas de muerte celular son habituales en el organismo: necrosis y apoptosis. Las características morfológicas de ambas permiten, en la mayoría de los tejidos, establecer claras diferencias.
A diferencia de la apoptosis, la necrosis es una forma de muerte celular que resulta de un proceso pasivo, accidental y que es consecuencia de la destrucción progresiva de la estructura con alteración definitiva de la función normal en un daño irreversible. Este daño está desencadenado por cambios ambientales como la isquemia, temperaturas extremas y traumatismos mecánicos. En la apoptosis el proceso afecta a determinadas células, no necesariamente contiguas, y no a todas en un área tisular. La membrana celular no se destruye, lo que impide el escape al espacio extracelular de su contenido resultando un proceso "silencioso" sin inflamación. En el citoplasma se produce granulación fina, con conservación de algunos orgánulos, en especial las mitocondrias que tienen un rol interactivo importante. A nivel nuclear la cromatina se condensa agrupada en varios sectores formando cuerpos apoptóticos. La membrana celular se recoge sobre las eminencias globuliformes que forman los elementos deteriorados del citoplasma y núcleo. Finalmente, fagocitos captan la célula en su totalidad impidiendo que se produzca alarma en el resto del tejido. Se ha demostrado, al menos en tejidos epiteliales, que si algo de material apoptótico escapa a la acción de los fagocitos es captado por células vecinas.5,6
La participación de células vecinas en este proceso se manifiesta además por la capacidad de éstas de enviar señales moleculares a la célula que debe morir como mecanismo complementario al que desarrolla la célula misma cuando se determina molecularmente su autodestrucción. El proceso de apoptosis dura entre 30 y 60 minutos en células en cultivo. Uno de los más lentos se produce en células hepáticas empleando como promedio 3 horas. El estudio e identificación específico de cuerpos apoptóticos se ha logrado con tinciones derivadas de la uridina (TUNEL en que la U corresponde a uridina). Sin embargo, en algunas células como las neuronas, la uridina tiñe también tejidos necróticos perdiendo la especificidad. En tales casos se recurre a anticuerpos monoclonales capaces de reconocer fragmentos de ADN integrados en los cuerpos apoptóticos. La imagen que da la apoptosis al microscopio electrónico se caracteriza por la presencia de fragmentos de cromatina agrupados en conglomerados globuliformes, la granulación fina del contenido citoplasmático, la persistencia de algunos orgánulos hasta el final del proceso, como las mitocondrias, y la integridad de la membrana celular. 3,7
Mecanismo
Dado que la apoptosis actúa como oponente a la mitosis, es muy importante su relación con el ciclo celular. En el ciclo celular hay cuatro fases: mitosis (M), fase de control celular G1, síntesis de ADN (S) y fase de control G2. La apoptosis puede iniciarse en el tercio final de G1 para impedir que una célula dañada ingrese a la fase de síntesis de manera que las mutaciones no se reproduzcan durante la replicación del ADN y en la fase G2 para impedir que las células que no hayan llegado a la madurez entren en mitosis.8
Los motores del ciclo celular son complejos proteicos formados por subunidades llamadas ciclinas y kinasas dependientes de ciclinas (CDK), sintetizados por genes específicos. La síntesis de estos complejos es constante porque son altamente inestables, de ahí que el nivel de ellos varíe de acuerdo al momento evolutivo de la fase a que están asignados. Así en el avance de la fase G1 a la S actúa la ciclina D asociada a las kinasas ciclinodependientes 2, 4 y 6 (cdk 2 4 6). En la segunda mitad del G1 aumenta la presencia de ciclina E con la kinasa ciclinodependiente 2. En la fase de síntesis actúa la ciclina A con CDK 2 y en la fase G2, la ciclina B con CDK 2. En la fase G1 se han podido determinar dos puntos importantes: G0 (en la mitad de la fase) donde el ciclo puede detenerse y la célula bloquea su crecimiento pero se mantiene metabólicamente activa y un punto de restricción (en unión de los 2/3 con 1/3 final de esta fase) en que se puede detener el ciclo para corregir defectos celulares (en especial de su ADN), lo que si no se consigue induce el mecanismo de muerte celular.9 En la fase G2 también existen elementos de detección de inmadurez celular que inducen la apoptosis cuando la célula no está capacitada para entrar en mitosis. De esta manera, durante el ciclo celular se determina cuándo la célula debe entrar en el proceso de autodestrucción o continuar el ciclo y dividirse. Se ejerce así un balance entre mitosis y apoptosis, regulando la población celular de cada tejido.10
En el mecanismo molecular que controla la apoptosis actúan varios agentes, de los cuales uno de los más importantes y mejor estudiados es el complejo de cisteinil-aspartato proteasas (caspasas). Se han descrito 11 caspasas en células humanas que provocan una degradación proteica bien definida hasta llegar a la formación de cuerpos apoptóticos. Algunas caspasas son "iniciadoras" y otras "efectoras" del proceso catalítico, actuando sobre endonucleasas que son las responsables directas de la fragmentación del ADN. La cadena de degradación proteica tiene sucesivos clivajes dependientes de la ubicación del ácido aspártico que se repite en la estructura de la enzima.
Se han descrito hasta 40 sustratos en la catálisis, proceso que en células cultivadas dura entre 30 y 40 minutos. La activación de las caspasas, que existen en calidad de pro-caspasas inactivas, se produce por diversas vías en que participan varios complejos moleculares.11
Vía extrínseca
La vía extrínseca o de los "receptores de muerte" establece conexiones con el espacio extracelular, recibiendo señales proapoptóticas desde el exterior y de las células vecinas. Dos familias de receptores se han identificado con estas características: la proteína Fas y el factor de necrosis tumoral (TNF).
La proteína transmembrana Fas en su porción intracelular enlaza con un factor intermedio denominado FADD (factor associated death domain), nombre que sólo señala que está comprometido con la zona de la molécula Fas que participa en la muerte celular, activando las caspasas-8 y -10. En cambio, si la parte interna de la molécula se asocia a otro factor llamado DaXX, se activan proteín-kinasas que conducen al efecto contrario, es decir, estimulan el ciclo celular y la mitosis. Esta vía Fas permanece inactiva hasta que se produce en su parte externa el enlace con un cofactor llamado ligando Fas, proteína que actúa como detonador que enciende una vía en que sólo las caspasas están inactivas y el resto de la cadena está preparado para recibir el enlace exterior. Esta característica permite actuar con gran rapidez sin necesidad de sintetizar otros factores.12
Algo similar sucede con el otro receptor de membrana TNF. Su porción intracelular conecta con complejos intermedios como el Tradd (TNF receptor associated death domain) y Raidd (receptor associated interleukine death domain) que activan caspasas "iniciadoras" de la apoptosis. Pero si se asocian a otro complejo llamado Traf (TNF receptor associated factor) activan proteín-kinasas y estimulan la proliferación celular, es decir, el efecto contrario.13
Las alternativas de una misma vía de actuar en pro o en contra de la apoptosis se repiten en otros mecanismos.5
Vía intrínseca o mitocondrial
Otra vía de inducción de apoptosis es la vía llamada mitocondrial. Las proteínas de la familia de Bcl-2 regulan la apoptosis ejerciendo su acción sobre la mitocondria. La activación de proteínas pro-apoptóticas de la familia de Bcl-2 produce un poro en la membrana externa de las mitocondrias que permite la liberación de numerosas proteínas del espacio intermembrana; entre ellas, el citocromo c.14,15
El citocromo c, una vez en el citosol, activa un complejo proteico llamado "apoptosoma", que activa directamente a la caspasa-9. Una vez que la caspasa-9 está activada, ésta activa a las caspasas efectoras como la caspasa-3, lo que desencadena las últimas fases de la apoptosis.16
El gen bcl-2 forma parte de una familia de genes que intervienen en la regulación de la supervivencia de la célula. Los miembros de la familia Bcl-2 están integrados por: Bcl-2, Bax, Bad, Bcl-X1, Bcl-Xs, Mcl-1. El destino de una célula de morir o sobrevivir está determinado por las diferencias en la expresión de estas proteínas, actuando algunas como promotoras y otras como inhibidoras de las señales de apoptosis.17
Las proteínas de la familia de Bcl-2 se agrupan en tres familias: la familia de las proteínas antiapoptóticas (Bcl-2, Bcl-Xl, Mcl-1 y otras); la familia de proteínas proapoptóticas de tipo "multidominio" (Bax y Bak) y las proteínas proapoptóticas de tipo "BH3-only" (Bid, Bim, Bad y otras). Las proteínas tipo multidominio pueden producir poros por si solas en liposomas, lo que indica que probablemente son suficientes para formar el poro mitocondrial que permite la liberación del citocromo c. Las proteínas tipo BH3-only activan a estas proteínas, y las antiapoptóticas inhiben la formación del poro. Estas proteínas son los reguladores más importantes del proceso de apoptosis. Una vez activado el apoptosoma, ocurre este cliva a la procaspasa 3, activándola a caspasa 3 la que es realmente la caspasa efectora; por otro lado a la salida de citocromo c desde la mitocondria, otra proteína llamada SMAC/DIABLO la cual es inhibidor de los inhibidores de caspasas (IAPS) sale de la misma. Así se tiene una vía en la que la caspasa efectora esta libre de actuar (dado que sus inhibidores fueron evitador por SMAC/DIABLO) y la apoptosis continua de forma natural.18
El bcl-2 se expresa de manera importante durante estadios muy tempranos de la diferenciación de células B y T, y también está altamente expresado en la etapa de diferenciación final de los linfocitos; es por ello que las células en estadios intermedios de desarrollo son más susceptibles a la muerte celular.19
Es importante destacar que Bcl-2 no confiere protección a la célula contra la apoptosis, ni en la selección negativa de células autoreactivas del timo, ni en los mecanismos citotóxicos de los linfocitos T citotóxicos (CTL). Tampoco se aprecia su efecto protector sobre las células B inmaduras que sufren apoptosis por entrecruzamiento IgM ni en la activación de la célula vía receptor Fas/TNF. 20
La vía mitocondrial puede conectarse también con la vía de receptores de muerte, ya que una vez activada la caspasa-8 por dichos receptores, esta caspasa activa a la proteína Bid, lo que provoca la apertura del poro mitocondrial y la activación de la caspasa-9.
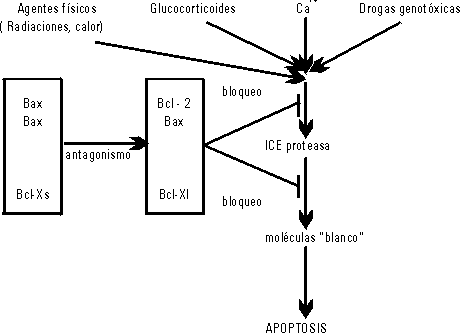
La figura 1 muestra la regulación de la apoptosis por la familia Bcl-2. Debe observarse como el heterodímero Bcl-2Bax y la variante Bcl-X1 tienen efecto inhibitorio de la muerte celular, al impedir la acción de las proteasas cisteínas que median señales de apoptosis. Sin embargo, la formación de homodímeros Bax-Bax, así como elevados niveles de Bax o Bcl-Xs, pueden favorecer la muerte programada de la célula.1
Figura 1. Regulación de la apoptosis por la familia Bcl-2.
Otros genes
Es conocido que ciertos oncogenes y genes supresores de tumor influyen en el mecanismo de muerte celular programada; tal es el caso de los genes c-myc y nur- que a pesar de estar asociados con la progresión del ciclo celular participan en la inducción de apoptosis en algunas células, también se encuentra el gen bcl-2 que como ya ha sido descrito, bloquea la apoptosis cuando es sobre expresado y el gen p53, cuyo requerimiento se produce en casos de daño genómico. La expresión de estos genes puede inducir a algunos tipos de cáncer a la apoptosis. Esto sugiere que la muerte celular programada es un mecanismo de defensa contra la transformación maligna.21
El gen p53 ha sido llamado guardián del genoma por ser el encargado de bloquear la división celular cuando las células han sufrido daño en su material genético. Este bloqueo lo lleva a cabo deteniendo las células en la fase G1 del ciclo celular, con el objetivo de que se produzca la reparación del DNA antes de que se replique. Este gen mantiene la integridad del genoma ya que estimula la apoptosis en las células en las que el daño en el DNA ha sido sustancial. En diversos tipos celulares incluyendo los linfocitos, la sobreexpresión de p53 conduce directamente a la apoptosis.22
La pérdida de la función normal del gen p53 puede conducir al desarrollo de neoplasias malignas; de hecho son muy frecuentes las alteraciones en este gen en una variedad de cánceres humanos (más del 50 % de los tumores humanos están asociados a mutaciones en p53). Hay evidencias que hacen pensar que el alto riesgo de la transformación maligna en ausencia de p53 funcional, probablemente origina una oportunidad reducida de reparar el DNA y una incapacidad de eliminar por apoptosis la célula dañada no reparada. Aunque es desconocida la base real de la apoptosis inducida por este gen.23
Los timocitos de ratón que pierden copias funcionales del p53 son incapaces de desarrollar apoptosis luego de ser irradiados; estas células responden normalmente a glucocorticoides y a señales a través del receptor.
Se ha evidenciado que los genes involucrados en una vía de apoptosis no necesariamente juegan una importante función en otra vía. Así por ejemplo nur77 se requiere para la apoptosis mediada por el receptor de células T (TCR), no siendo importante en la muerte celular por glucocorticoides o radiación ionizante. A pesar de esto, se ha observado en ratones deficientes de nur77, muerte celular mediada por el receptor, sugiriéndose que, o bien este gen no es requerido in vivo para la apoptosis, o existe un gen estrechamente relacionado con él que puede compensar su deficiencia.24
Estudios anteriores sugieren la influencia de la expresión de nur77 en la proliferación o la diferenciación celular.15
El producto de nur77 es una proteína que pertenece a la familia del receptor nuclear de hormonas esteroides y su efecto en la apoptosis está dado porque actúa como un factor de transcripción que regula la expresión de genes involucrados en la muerte celular.25
Otro regulador fisiológico del ciclo celular que participa en la apoptosis es la proteína Myc, que es producto del proto-oncogen c-myc. La sobreexpresión del gen c-myc pudiera resultar en mitosis o apoptosis en dependencia de la disponibilidad de otros factores que estimulan el crecimiento celular. De esta forma la expresión incrementada de Bcl-2 en presencia de un aumento de c-myc provoca una inhibición de la apoptosis mediada por c-myc, lo que explica la cooperación que se produce entre ambos genes en el origen de las neoplasias.6
Además del papel que juega la apoptosis en el origen del cáncer, su modulación también pudiera influir en el tratamiento de esta enfermedad.18
Funciones de la apoptosis
Eliminación de tejidos dañados o infectados
La apoptosis puede ocurrir, por ejemplo, cuando una célula se halla dañada y no tiene posibilidades de ser reparada, o cuando ha sido infectada por un virus.16
La "decisión" de iniciar la apoptosis puede provenir de la célula misma, del tejido circundante o de una reacción proveniente del sistema inmune. Cuando la capacidad de una célula para realizar la apoptosis se encuentra dañada (por ejemplo, debido a una mutación), o si el inicio de la apoptosis ha sido bloqueado (por un virus), la célula dañada puede continuar dividiéndose sin mayor restricción, resultando en un tumor que puede ser de carácter canceroso. Por ejemplo, como parte del "secuestro" del sistema genético de la célula llevado a cabo por los virus del papiloma humano (VPH), un gen denominado E6 se expresa originando un producto que degrada la proteína p53, vital para la ruta apoptótica.21
También condiciones de stress como la falta de alimentos, así como el daño del ADN provocado por tóxicos o radiación, pueden inducir a la célula a comenzar un proceso apoptótico. Un ejemplo sería la apoptosis mediada por la enzima nuclear, poli-ADP-ribosa polimerasa-1 (PARP-1), crucial en el mantenimiento de la integridad genómica. Una activación masiva de dicha enzima puede depletar la célula de nucleótidos ricos en energía, provocando una cadena de transducción de señales del núcleo a la mitocondria que iniciaría la apoptosis.16
La muerte celular programada es parte integral del desarrollo de los tejidos tanto de plantas (viridiplantae) como de animales pluricelulares (metazoa), y no provoca la respuesta inflamatoria característica de la necrosis. En otras palabras, la apoptosis no se parece al tipo de reacción resultante del daño a los tejidos debido a infecciones patogénicas o accidentes. En lugar de hincharse y estallar y, por tanto, derramar su contenido, posiblemente dañino, hacia el espacio intercelular-, las células en proceso de apoptosis y sus núcleos se pliegan, y con frecuencia se fragmentan. De esta manera, pueden ser eficientemente englobadas vía fagocitosis y, consecuentemente, sus componentes son reutilizados por macrófagos o por células del tejido adyacente.
Homeostasis
En un organismo adulto, la cantidad de células que componen un órgano o tejido debe permanecer constante, dentro de ciertos límites. Las células de la sangre y de piel, por ejemplo, son constantemente renovadas por sus respectivas células progenitoras. Por lo tanto, esta proliferación de nuevas células tiene que ser compensada por la muerte de otras células. A este proceso se le conoce como homeostasis, aunque algunos autores e investigadores,16 han sugerido homeocinesis como un término más preciso y elocuente.
La homeostasis se logra cuando la relación entre la mitosis y la muerte celular se encuentra en equilibrio. Si este equilibrio se rompe, pueden ocurrir dos cosas:
Ambos estados pueden ser fatales o potencialmente dañinos.16
Regulación del sistema inmunitario
Ciertas células del sistema inmunitario, los linfocitos B y linfocitos T, son sofisticados agentes de la respuesta defensiva del organismo frente a infecciones así como células propias que hayan adquirido o desarrollado algún tipo de malignidad. Para llevar a cabo su trabajo, las células B y T deben tener la habilidad de discriminar lo propio de lo extraño y lo sano de lo enfermo, gracias a la especialidad de sus receptores. De hecho, los linfocitos T citotóxicos pueden ser activados por fragmentos de proteínas expresadas inapropiadamente (derivadas, por ejemplo, de una mutación maligna) o por antígenos extraños producidos como consecuencia de una infección intracelular. Después de activarse tienen la capacidad de migrar, proliferar y reconocer las células afectadas, induciendo una respuesta de muerte celular programada.
Los receptores de las células B y T inmaduras no se generan por procesos de una elevada precisión, sino por procesos aleatorios de elevada capacidad para generar variabilidad. Esto significa que muchas de estas células inmaduras pueden no ser efectivas (porque su receptor no sea capaz de unir ningún antígeno conocido) o ser peligrosas para el propio organismo porque sus receptores sean capaces de reconocer con elevada afinidad antígenos propios. Si estas células fuesen liberadas sin otros procesamientos, muchas podrían volverse autoreactivas y atacar células sanas. El mecanismo por el que el sistema inmune regula este proceso es la eliminación tanto de los no efectivos como los potencialmente auto reactivos mediante apoptosis.24
Como se ha descrito en los anteriores apartados, todos los tejidos dependen de una continua recepción de señales de supervivencia. En el caso de las células T, mientras se desarrollan y maduran en el timo, las señales de supervivencia dependen de su capacidad para reconocer antígenos extraños. Aquellas que no superan esta prueba, alrededor de un 97 % de las células T producidas, son eliminadas por apoptosis. Las supervivientes son testadas a su vez frente a antígenos propios, y aquellas que reconocen estos antígenos con elevada afinidad son eliminadas de la misma manera.22
También los linfocitos T maduros, bajo ciertas condiciones, pueden sufrir apoptosis, lo que corrobora su papel inmunorregulador. Entre los factores que pueden inducir apoptosis en células maduras están: los glucocorticoides y las radiaciones gamma, la estimulación del complejo TCR/CD3 por anticuerpos monoclonales, Ags nominales y superantígenos y la estimulación de los receptores CD2, Fas/Apo-1 y TNF.
Se ha demostrado que la sensibilidad para lograr la apoptosis es más lenta en células maduras y requiere previa activación. La ruta que siguen los linfocitos T al ser estimulados depende de una serie de elementos que determinan si la célula prolifera, o si muere por apoptosis. La figura 2 muestra los diversos factores que influyen en dicha decisión.
Por lo tanto, el desarrollo de un sistema inmune maduro y efectivo depende de una serie de reguladores positivos y negativos de las vías de apoptosis.24
Figura 2. Factores que regulan la ruta de las células T activadas, después del reencuentro con el Aq.
Enfermedades vinculadas con la apoptosis
La apoptosis es una función biológica de gran relevancia en la patogenia de varias enfermedades estudiadas hasta el momento. Se puede destacar el cáncer, malformaciones, trastornos metabólicos, neuropatías, lesiones miocárdicas y trastornos del sistema inmunitario.
Enfermedades asociadas a inhibición de apoptosis:
Cáncer: linfoma no Hodgkin folicular (Bcl-2 +), carcinoma (p53 +), tumores hormono-dependientes
Enfermedades auto inmunitarias: lupus eritematoso sistémico, glomerulonefritis auto inmunitaria
Infecciones virales: Herpes virus, Poxvirus, Adenovirus
Enfermedades asociadas a aumento de apoptosis:
Sida
Enfermedades neurodegenerativas: enfermedad de Alzheimer, enfermedad de Parkinson, esclerosis lateral amiotrófica, retinitis pigmentosa, degeneración cerebelosa
Síndromes mielodisplásicos (MDS): anemia aplástica
Daño isquémico: infarto de miocardio, apoplejía, daño por reperfusión, daño hepático por alcoholismo.24
La apoptosis ha sido tema de creciente atención en la Biología celular y en el estudio del desarrollo de los organismos, así como en la investigación de enfermedades tales como el cáncer. Así lo demuestra el hecho que el premio Nobel año 2002 para Fisiología y Medicina fuese otorgado a Sydney Brenner (Gran Bretaña), H. Robert Horvitz (EE. UU) y John E. Sulston (GB) "por sus descubrimientos concernientes a la regulación genética del desarrollo de órganos y la muerte celular programada".
Se concluye que la apoptosis es una forma de muerte celular genéticamente programada que tiene una vía extrínseca relacionada con los receptores de la muerte (Fas y el factor de necrosis tumoral TNF); y una intrínseca relacionada con la familia Bcl-2,la misma juega un papel fundamental en la eliminación de tejidos dañados, evitando la proliferación de células cancerosas, es muy importante en el desarrollo embrionario, ya que es un mecanismo morfogenético logra la homeostasis, manteniendo el número de células adecuadas en cada tejido, regula el sistema inmunitario, eliminando las células T que no reconocen antígenos extraños y a las células T que reconocen antígenos propios con elevada afinidad, está relacionada con enfermedades como el cáncer; lupus; herpesvirus; poxvirus; adenovirus; sida; enfermedad de Alzheimer; enfermedad de Parkinson; esclerosis lateral amiotrófica; retinitis pigmentosa; degeneración cerebral; anemia aplástica; daño isquémico; infarto de miocardio; apoplejía; daño por repercusión; daño hepático por alcoholismo.
Lic. Jorge Pérez Machado. Licenciado en Enfermería. Especialista de I grado en Embriología. Profesor Auxiliar e Investigador Agregado. Máster en Atención Integral a la Mujer y Educación Médica Superior. Facultad de Ciencias Médicas Mayabeque. Güines. Cuba. E-mail: jperezm@infomed.sld.cu