REVISIÓN BIBLIOGRÁFICA
Yelina Gorrita Pérez,I Remigio R. Gorrita PérezII
ILicenciada en Enfermería. Profesor Instructor. Máster en Atención Integral al Niño. Policlínico Universitario “Santiago Rafael Echezarreta Mulkay”. San José de las Lajas, Mayabeque, Cuba.
IIEspecialista de II grado en Pediatría. Profesor e Investigador Auxiliar. Máster en Atención Integral al Niño. Policlínico Universitario “Santiago Rafael Echezarreta Mulkay”. San José de las Lajas, Mayabeque, Cuba.
Se realizó una revisión bibliográfica con el objetivo de interpretar la repercusión de las microdeleciones del cromosoma Y en la infertilidad masculina, abordar sus mecanismos moleculares e identificar la importancia del diagnóstico para establecer un manejo adecuado de estos pacientes. Se utilizaron las bases de datos GOOGLE, MEDLINE, EBSCO, HOST, DOYMA, la Literatura Cubana de Medicina de los últimos diez años; y algunos clásicos de la temática, localizados en los órganos de información del Sistema Nacional de Información de Ciencias Médicas. El estudio de la espermatogénesis ha permitido identificar diferentes factores genéticos implicados en la esterilidad masculina, localizados en el cromosoma Y: región AZF, que se encuentra divida en cuatro locus (AZFa, AZFb, AZFc y AZFd), y contienen diferentes genes implicados en el control de la espermatogénesis, llamados genes candidatos. Las microdeleciones en ellos están asociadas con fallos espermatogénicos que se manifiestan como azoospermias y oligozoospermias severas. El avance en las técnicas de biología molecular y el mapeo del cromosoma Y ha permitido el diagnóstico de microdeleciones no detectadas en los estudios de cariotipo. El cribado de microdeleciones en el cromosoma Y permite identificar importantes etiologías dentro de la infertilidad masculina, posee un valor pronóstico y nos permite realizar un adecuado consejo genético a la pareja y su tratamiento
Palabras clave: cromosoma Y, infertilidad masculina.
ABSTRACT
A bibliographical review was performed in order to interpret the impact of Y chromosome microdeletions in male infertility, address their molecular mechanisms and identify the importance of diagnosis to establish a proper management of these patients. GOOGLE, It was used MEDLINE, EBSCO HOSTand DOYMA databases, the Cuban Medical Literature of the last ten years, and some classics on the subject, which are located in the information services of the National Medical Sciences Information System. The spermatogenesis study has enabled the identification of various genetic factors involved in male sterility on Y chromosome: AZF region, which is divided into four locus (AZFa, AZFb, AZFc and AZFd) and they contain different genes involved in spermatogenesis control, called candidate genes. Microdeletions in them are associated with spermatogenic faults which manifest as azoospermia and severe oligozoospermia. Advances in molecular biology techniques and mapping of the Y chromosome has allowed the diagnosis of undetected microdeletions in karyotype studies. Screening for microdeletions on the Y chromosome can identify important etiologies in male infertility, it has a prognostic value, allowing to perform adequate genetic counseling to the couple and their treatment
Key words: Y chromosome, male infertility.La infertilidad es un problema que afecta una de cada 6 o 10 parejas. Para otros investigadores de un 15 a 30 % de las parejas en edad reproductiva son infértiles. La infertilidad se define como la imposibilidad de una pareja para concebir después de un año de vida sexual regular, sin la utilización de algún método de regulación de la fecundidad. La infertilidad depende tanto de factores masculinos como femeninos.1 De acuerdo con la Organización Mundial de la Salud (OMS) el factor masculino está presente aproximadamente en 40 % de las parejas infértiles, generalmente asociado a la calidad y a la cantidad de esperma, es atribuible a la mujer en el otro 40 % de los casos y el restante 20 % se atribuye a ambos.1-3
La infertilidad masculina se asocia a causas anatómicas (criptorquidia, hipospadias), endocrinas (hipogonadismo hipogonadotrópico), infecciosas (parotiditis postpuberal, enfermedades de transmisión sexual), nutricionales, traumáticas (consecuencia de cirugía inguinoescrotal), disfunciones sexuales (eréctiles, eyaculatorias), trastornos inmunológicos, genéticos, lesiones neurológicas, factores ambientales y tóxicos o idiopáticos.4-6
Las causas genéticas involucran a menos del 5 % de los casos de infertilidad masculina, las cuales son más frecuentes en la medida que se identifica una concentración más baja de espermatozoides (4,7). Del 7 al 10 % de los pacientes cuya esperma tiene menos de 5 millones de espermatozoides por ml, presentan pruebas genéticas anormales.8
Entre los factores genéticos más frecuentes asociados a la infertilidad masculina están: Las anormalidades en el cariotipo y las Microdeleciones en el cromosoma Y.2
Las aberraciones cromosómicas pueden ser numéricas o estructurales y afectar tanto a los autosomas como a los cromosomas sexuales. Los cromosomas que tienen hasta el momento un mayor número de aberraciones cromosómicas viables reportadas, son los cromosomas sexuales X y Y, existiendo notables diferencias entre las aberraciones cromosómicas autosómicas y las aberraciones cromosómicas sexuales.
Dentro de las aberraciones cromosómicas estructurales encontramos las deleciones que consisten en la pérdida de un fragmento de un cromosoma y se clasifican de acuerdo con el número de puntos de rupturas: en terminales (una sola ruptura) o intersticiales (dos rupturas), perdiéndose el segmento roto. Por lo general, estas alteraciones son resultado de un error producido durante el desarrollo de un ovocito o de la célula espermática.9
Recientes estudios han sugerido una alta prevalencia de microdeleciones del cromosoma Yq en hombres infértiles; y nos muestran que graves alteraciones seminales se relacionan con microdeleciones del brazo largo del cromosoma Y, entre un 10 y 15 % de los casos.10 La prevalencia de estas deleciones en el cromosoma Y oscila entre un 5-10 % de los varones oligozoospérmicos y un 15 % de los azoospérmicos.11
La azoospermia es la ausencia de espermatozoides en el eyaculado, representa aproximadamente entre el 2 y el 3 % de los trastornos de fertilidad masculina vistos en consulta de infertilidad 12 y se ha descrito que el 30 % de los hombres con azoospermia idiopática tienen deleciones del cromosoma Y.13 Existen dos tipos de azoospermia: la obstructiva, que se caracteriza por una obstrucción de los conductos que no permiten el paso de los espermatozoides del testículo al eyaculado, y la no obstructiva o secretora, que consiste en una falla en la espermatogénesis (proceso mediante el cual se originan los espermatozoides en el testículo), que da lugar a una producción aparentemente nula de espermatozoides.12
El cromosoma Y es necesario para la fertilidad masculina. La infertilidad masculina se ha asociado con alteraciones estructurales del cromosoma Y en hombres azoospérmicos y seriamente oligozoospérmicos. El intervalo 5-6 de la banda Yq11 de este cromosoma contiene un “factor de infertilidad” o “factor azoospérmico” (AZF). Esta región consta de por lo menos cuatro zonas(a, b, c y d) que controlan la espermatogénesis. Diferentes deleciones de esta región pueden causar defectos importantes que van desde azoospermia no obstructiva hasta oligozoospermia 2,14 y se han descrito fenotipos específicos de infertilidad adscritos a cada región.15
Estas microdeleciones en el brazo largo del cromosoma Y conducen a la disfunción de genes vitales para la espermatogénesis, debido a la pérdida de segmentos específicos de ácido desoxirribonucleico (ADN), considerándose éstas como la causa genética más frecuente de infertilidad, siendo la más común la confinada a la región AZFc, que contiene al gen DAZ (involucra 13 % de los hombres azoospérmicos y 6 % con oligozoospermia severa).4,16
Los estudios para identificar las deleciones del cromosoma Y se basan en técnicas de amplificación del ADN a través de la PCR (reacción en cadena de la polimerasa) que delimita localizaciones de regiones específicas del cromosoma Y, denominadas “sequence tagged sites” (STS) que son específicas de un gen o locus.11,15
El análisis de la secuencia de genes específicos en el cromosoma Y que codifican para algún desorden es importante, ya que establece el grado de alteración del DNA para la aparición de la enfermedad, y nos demuestra la existencia de regiones en el cromosoma Y donde se encuentran los genes responsables de la espermatogénesis, y permite la implementación de técnicas diagnósticas y crean las expectativas en un futuro de desarrollar una terapia génica.15-16
Esta alteración genética y seminal se trasmitirá al 100% de la descendencia masculina, quienes también serán infértiles si eligen usar su propio esperma para lograr un embarazo, de ahí que sea mandatario realizar estudios de zona AZF en todos los varones oligozoospérmicos graves o azoospérmicos candidatos a ICSI (intracitoplasmatic sperm injection) para no cometer graves errores en la utilización de esa compleja técnica.10,13
Dado la importancia que se le confiere a las deleciones del cromosoma Y como causa genética de infertilidad masculina, la posibilidad de transmisión de este trastorno a la descendencia, y la eventualidad de detectarse mediante técnicas de PCR, que nos puede servir a la hora de realizar el consejo genético a la pareja que se va a someter a microinyección espermática los autores decidieron hacer una revisión bibliografica sobre esta temática para explorar la repercusión de las microdeleciones del cromosoma Y en la infertilidad masculina, abordar los mecanismos moleculares que intervienen en las microdeleciones del cromosoma Y e identificar la importancia del diagnóstico de las microdeleciones del cromosoma Y para establecer un manejo adecuado de estos pacientes.
Antecedentes históricos
Estructura del cromosoma Y
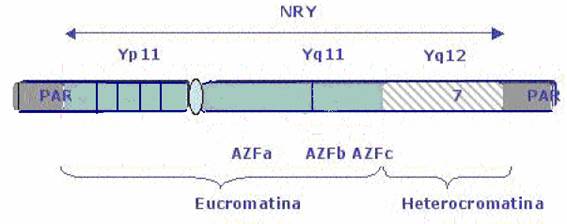
El cromosoma Y es el cromosoma humano más pequeño, está compuesto de dos brazos y un centrómero. El brazo largo se denomina Yq y el corto Yp. En regiones distales de ambos brazos se encuentran secuencias homólogas al cromosoma X, que se denominan regiones pseudoautosómicas (PARs). Debido a su elevada identidad de secuencia ambas regiones recombinan entre sí durante la meiosis. Fuera de estas regiones se encuentra la región no recombinante (NRY), que consta de secuencias repetitivas homólogas al cromosoma X y específicas del cromosoma Y.
Desde el punto de vista citogenético se diferencia una región heterocromatínica distal, Yq12, y una región eucromatínica proximal Yq11 (subdividida en Yq11.1,11.21, 11.22,11.23) en el brazo largo. El brazo corto únicamente comprende una región eucromatínica denominada Yp11.11
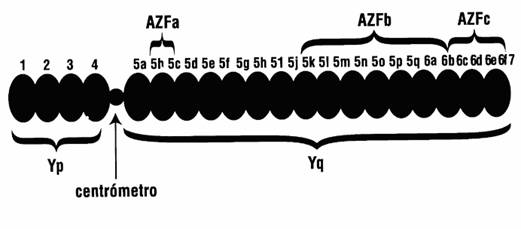
Empleando una técnica denominada mapeo de deleciones se ha dividido en siete intervalos de deleción, que posteriormente se subdividieron en subintervalos designados con letras correlativas del alfabeto: a, b, c,... En el brazo corto se sitúan los intervalos del 1 al 4, y en el largo del 5 al 7(los intervalos 5 y 6 comprenden la región eucromatínica de Yq, y finalmente la región heterocromatínica se identifica como el intervalo 7)11,18 (figura 1 y figura 2)
Fig. 1 y Fig. 2: Representaciones esquemáticas del cromosoma Y.
Posteriormente estos 7 intervalos se subdividieron en 43 subintervalos dando lugar al mapa más empleado en la actualidad.11
Gracias a la secuenciación del cromosoma Y se han podido generar y localizar más de 300 STSs11 (figura 3); y se ha podido determinar que la mitad del cromosoma Y consiste en repeticiones en tándem (DNA satélite) y que el resto de secuencia posee pocos genes. En concreto se han identificado 156 unidades transcripcionales que incluyen 76 genes que codifican para proteínas. Muchos de estos genes corresponden a duplicaciones o genes de múltiples copias, por lo que estos 76 genes dan lugar a tan sólo 27 proteínas distintas.17
Estos genes en función de su localización, número de copias y patrón de expresión pueden ser clasificados en 3 grupos:
* Genes pseduoautosómicos (como ASMTL, MIC2, IL9R). Las secuencias son idénticas en los cromosomas X e Y. Se expresan, salvo excepciones, en diferentes tejidos.
* Genes localizados en la región NRY homólogos X-Y (como USP9Y, DBY, UTY). Codifican proteínas que poseen alto grado de identidad con homólogos del cromosoma X. Se expresan en diferentes tejidos, aunque se han identificado transcritos específicos de tejido testicular.
* Genes específicos del cromosoma Y (como DAZ, CDY, PRY) son genes multicopias y se expresan específicamente en el tejido testicular.
Una excepción a esta clasificación es el gen SRY que determina el desarrollo de los testículos, siendo específico del cromosoma Y, en copia única y limitada su expresión a la cresta genital, células germinales y de Sertoli fetales y adultas.11
Fig. 3: Mapa de los STS a lo largo del cromosoma Y y genes relacionados con la espermatogénesis
Espermatogénesis
La espermatogénesis depende de una cascada regulada por genes que coordinan la proliferación espermatogonial, las divisiones reduccionales y la diferenciación morfológica que concluyen con la maduración espermática.11 Es el proceso de meiosis y diferenciación celular que convierte a las células germinales primitivas en gametos masculinos maduros (espermatozoides) o células sexuales maduras aptas para la fecundación.19 Tiene como finalidad reducir el número diploides de cromosomas, al número haploides que se observa en los gametos; lo cual se logra por las divisiones meióticas que ocurren durante el proceso y además modificar la forma de las células germinativas preparándolas para la fecundación.20
La espermatogénesis es un proceso continuo que se inicia en la pubertad. Ocurre en ciclos sucesivos a lo largo de cada túbulo seminífero de los testículos. En intervalos regulares de cada 2-3 semanas se inician nuevos ciclos antes de que se completen los anteriores. Tal sucesión asegura una producción continúa e ininterrumpida de nuevos espermatozoides hasta la muerte. (100-200 millones espermatozoides por día).21
Durante la vida prenatal en el varón ocurre la formación de un estrato o capa de células germinativas primordiales (CGP) que se mantienen en reposo desde la sexta semana del desarrollo embrionario hasta la pubertad, momento en que los túbulos seminíferos maduran y comienza realmente el proceso de espermatogénesis, transitando por el período de proliferación donde las CGP(diploides) en reposo reanudan su desarrollo se dividen varias veces por mitosis, aumentando en número y acaban diferenciándose a espermatogonias; en el período de crecimiento las espermatogonias crecen y experimentan cambios graduales que las transforman en espermatocitos primarios, que son las células germinales más grandes en los túbulos seminíferos y en el período de maduración, los espermatocitos primarios dan origen a dos espermatocitos secundarios (casi la mitad del tamaño de los espermatocitos primarios) durante la primera división meiótica y a cuatro espermátides haploides en la segunda división. De las 4 espermátides que origina un espermatocito primario, dos contienen el cromosoma X y las otras dos el cromosoma Y.21
En la espermatogénesis ocurre un período adicional que es conocido como espermiogénesis en el que las espermátides experimentan cambios morfológicos y se transforman en espermatozoides, estos cambios son: Condensación del núcleo, formación del acrosoma (contiene enzimas que ayudan a la penetración del ovocito durante la fecundación), eliminación de la mayor parte del citoplasma, formación del cuello, pieza intermedia y cola.19,20
Concluida la espermiogénesis (64 días aproximadamente después del comienzo de la espermatogénesis) en los túbulos seminíferos, los espermatozoides están maduros desde el punto de vista morfológico pero son inmóviles e incapaces de fecundar al ovocito. Son transportados desde los testículos al epidídimo donde experimentan un proceso de maduración bioquímica (adquieren una cubierta de glucoproteínas y modifican su superficie). La maduración bioquímica final y el equipamiento de energía se producen cuando los espermas eyaculadores se mezclan con las secreciones de la próstata y las vesículas seminales durante la eyaculación.21
El espermatozoide es una célula altamente especializada bien adaptada para la locomoción y transportar su material genético hasta el sitio de unión con el ovocito para la formación de un nuevo individuo.
En un hombre normal vamos a encontrar en su cromosoma Y además de los genes específicos para la diferenciación de la gónada primitiva en un testículo, los genes relacionados con la espermatogénesis.9 Cualquier alteración en los genes que intervienen en la espermatogénesis, es decir aquellos que se expresan específicamente en el tejido testicular, traerá como resultado una deficiencia en la producción de espermatozoides.
Se considera que muchas de las anomalías cromosómicas se producen durante la gametogénesis (producción de los gametos femeninos y masculinos). Estas anomalías pueden producirse en la línea germinal de cualquiera de los dos progenitores por un error en la meiosis o la fecundación, o surgir en las primeras etapas del embrión por errores de las mitosis. Aunque no está bien esclarecido a que nivel se producen estas alteraciones, se considera que las células en profase meiótica son las más susceptibles.16,19
Factor de azoospermia (azf)
Anteriormente nos hemos referido a la presencia de genes específicos del cromosoma Y que se expresan en el tejido testicular, los cuales están muy relacionados con la fertilidad masculina. Estos genes se localizan en el brazo largo del cromosoma Y (Yq 11), regulan la espermatogénesis y se conocen como azoospermic zone factor (AZF). En los intervalos 5 y 6 del mapa del cromosoma Y se pueden localizar los distintos locus del AZF.10
La región AZFa tiene aproximadamente un tamaño de un millón de pares de bases, se localiza en la zona 5c-5d, abarca genes que presentan copias homólogas en el cromosoma X y que además se expresan de manera ubicua.
La AZFb tiene un tamaño de tres millones de pares de bases, se localiza desde 5k hasta 5q y de 6a a 6b.
La AZFc sería la inicialmente denominada Factor de Azoospermia, tiene un tamaño de 1,4 millones de pares de bases, se localiza en 6c hasta 6f. Este gen tiene una copia en el brazo corto del cromosoma 3.
Recientemente se ha descrito otra región denominada AZFd localizada entre la AZFb y la AZFc pero sin haber encontrado aún ningún gen en ella.18
Entre los 3 locus AZF la incidencia de deleciones es mayor en AZFc (60 %), siendo menor en AZFb (16 %), y en AZFa. 5 % En deleciones combinadas AZFb+c (9 %) es la mayoritaria, mientras que AZFa+b 2 % y AZFa+b+c (4 %) son menos frecuentes.11
Genes candidatos del azfLa explicación de por qué estos locus están asociados a un fallo testicular reside en la localización de diferentes genes implicados en la espermatogénesis. Debido a su función se expresan específicamente en el tejido testicular, y se denominan genes candidatos AZF.
Genes candidatos AZFa. Los genes identificados en esta región y
delecionados en individuos infértiles de forma independiente o combinada
son:
-USP9Y (ubiquitina-proteasa 9 específica, cromosoma Y) o (DFFRY) Drosophila
Fat-Facets Related Y).
-DBY (DEADbox del cromosoma Y)
-UTY (motivo TPR del cromosoma Y). Su función es desconocida
El gen USP9Y (DFFRY) codifica una proteína con actividad C-terminal ubiquitina hidrolasa homóloga a la proteína faf de Drosophila implicada en la degradación de factores de transcripción específicos. Como consecuencia, USP9Y podría regular la cascada de transducción de señales en la espermatogénesis.
El gen DBY codifica una proteína que contiene un motivo DEADbox que es característico de las helicasas de RNA dependientes de ATP y por tanto tiene un papel importante en el metabolismo del RNA.
Estudios recientes sugieren que deleciones que afectan a varios genes del AZFa actúan sinérgicamente provocando fenotipos más severos. El gen que se encuentra con mayor frecuencia delecionado en AZFa es DBY. Sin embargo, su función en el desarrollo de la línea germinal es todavía desconocida.11
Genes candidatos AZFb. En este locus se localiza:
-EIFIAY (Factor de iniciación de la traducción 1A)
-RBMY (Motivo de unión al RNA del cromosoma Y)
-HSFY (Factor de choque térmico del cromosoma Y)
EIFIAY codifica la isoforma Y del eIF-A.
Su expresión es independiente de tejido, pero existen transcritos específicos de tejido testicular.
El primer gen identificado como gen candidato de la espermatogénesis se localizó en el AZFb, y se denominó: RBMY consiste en una familia multicopia de genes (30-40 copias) muchos de los cuales son pseudogenes y se encuentran repartidos en todo el cromosoma Y. Codifican proteínas nucleares que contienen motivos de unión al RNA.
Existen genes homólogos localizados en el cromosoma X (RBMX), sin embargo su expresión es inespecífica de tejido. Sólo los que están localizados en la región AZFb y organizados en tándems repetitivos se expresan en células germinales, presentando una función directa en la espermatogénesis actuando sobre el procesamiento y maduración del mRNA. Por todo ello, se convierte en el gen candidato más importante. El hecho de la existencia de muchas copias del gen implica que se necesitan grandes cantidades de producto para poder obtener un recuento espermático adecuado. La deleción de ciertas copias (efecto dosis) podría manifestarse como oligozoospermias, más que como azoospermias debido a los niveles insuficientes de transcritos, en lugar de la ausencia de uno particular.
El gen HSFY tiene importantes implicaciones en la espermatogénesis y delecionado en azoospérmicos. Está constituido por una familia multicopia de genes repartidos en todo el cromosoma Y, codifica una proteína nuclear que contiene motivos de unión al DNA, y sufre una translocación al citoplasma en diferentes fases del proceso espermatogénico. Se expresan específicamente en las células de Sertoli y células germinales. La deleción de este locus siempre se ve acompañada de RBMY.11
Genes candidatos AZFc: En este locus también se ha identificado la presencia de una familia de genes multicopia con la típica disposición de repeticiones en tándem, llamados genes DAZ (Deleted in Azoospermia). Su expresión se da a nivel de tejido testicular y se sabe que éste codifica para proteínas de enlace de RNA. Así mismo, posee influencia sobre el destino de la célula espermatogónica, bloqueando o facilitando la diferenciación celular, la cual altera la expresión de proteínas que se encargan de la diferenciación post-meiótica de esta célula gamética.16
El gen DAZ codifica una proteína con un dominio N-terminal de unión a RNA y un C-terminal con secuencias repetidas de 24 aminoácidos. La expresión de DAZ comienza en las espermatogonias, siendo máxima en los espermatocitos primarios y volviéndose a reiniciar en las colas de los espermatozoides maduros. Los transcritos localizados en las células germinales pueden regular el almacenamiento o transporte de mRNA específicos. La complejidad de expresión de este gen se incrementa debido al elevado número de copias (efecto dosis) y a los distintos transcritos que se pueden obtener de cada gen por el splicing alternativo. Aunque DAZ no es el único gen en la región distal de Yq, su elevada prevalencia de deleciones en individuos infértiles lo convierte en el mejor candidato AZFc.11,17
Se ha observado que las deleciones en Yq que incluyen los DAZ ocurren de novo y no están presente en los padres o hermanos fértiles de varones infértiles, lo cual es consistente con su papel causal en la infertilidad masculina.
Sin embargo, la transmisión vertical de una deleción que involucra el gen DAZ, desde padre a hijo ha sido informada solo en pocos casos. En un reciente estudio realizado por Elkin Lucena y colaboradores sobre la determinación de deleciones en hombres infértiles se reportó una familia que presenta deleción del gen DAZ durante tres generaciones en línea directa. Esto provee evidencia de que una deleción en Yq puede originar una expresión fenotípica variable en los diferentes individuos analizados dentro de un mismo núcleo familiar, lo que es clínicamente significativo, ya que la presencia de una deleción no es absolutamente un marcador para infertilidad y puede estar asociado con aparente fertilidad que en la segunda o tercera etapa de la vida puede conducir al desarrollo de un fenotipo testicular severo como azoospermia no obstructiva.16
Otros genes identificados en AZFc son: CDY1, BPY2, PRY (tirosin fosfatasa) y TTY (transcritos específicos de tejido testicular de función desconocida).
La función de estos genes es desconocida, sin embargo comparten características comunes: son genes multicopia, se expresan sólo en tejido testicular y son específicos del cromosoma Y. La implicación de estos genes en la espermatogénesis es desconocida, ya que siempre su deleción se encuentra asociada a DAZ, no pudiendo ser considerados como genes candidatos verdaderos.
Manifestación fenotípica de los azf
De modo que, microdeleciones en estos locus están asociadas con fallos espermatogénicos manifestándose como azoospermias y oligozoospermias severas con diferentes patologías testiculares desde SCOS (Síndrome de solo células de Sertoli) hasta hipoespermatogénesis.11
En los últimos años se ha tratado de correlacionar los diferentes tipos de deleciones y su posible manifestación fenotípica, es decir, su repercusión sobre la fertilidad masculina.18 Actualmente a más de 4 800 hombres infértiles se les ha realizado tamizaje para deleciones en este cromosoma las cuales determinan las posibles causas de los fenotipos de azoospermia no obstructiva y oligozoospermia severa que involucran en el mayor de los casos la región AZFC en la cual se localiza la familia del gen DAZ.16
Hasta el momento, poco se sabe sobre la bioquímica o la biología de las proteínas codificadas por los genes del cromosoma Y. Se sabe que algunas podrían intervenir en el proceso de maduración espermática, a través de su actuación en los procesos postranscripcionales, otras durante la fase de mitosis o meiosis.
Evidencias derivadas de la histología testicular sugieren que la espermatogénesis se interrumpe en la misma fase cuando se producen deleciones de la misma región. Es decir, deleciones localizadas en puntos concretos del cromosoma Y actuarían en una etapa específica de la espermatogénesis.18
De este modo, la deleción de la región AZFa se asocia con el Síndrome de solo células de Sertoli tipo I (SCOS) en los que los individuos afectados presentan testículos pequeños, poblados únicamente con células de Sertoli y azoospermia. Más raramente asociadas a oligozoospermias severas por hipoespermatogénesis severas, y bloqueo de la maduración. Diferentes estudios muestran que deleciones del gen DBY en la región AZFa están asociados tanto a SCOS como a hipoespermatogénesis severas, sugiriendo que este gen puede regular las primeras fases del proceso espematogénico o la actividad de las espermatogonias. Por el contrario la deleción de USP9Y, así como su mutación puntual determinan sólo hipoespermatogénesis.11
Cuando tenemos deleciones de la AZFb, se observa en la mitad de los casos un bloqueo de la meiosis. Las poblaciones de espermatogonias y de espermatocitos primarios son normales, sin embargo no se observan células germinales postmeióticas, no obteniendo espermatozoides válidos para ICSI en la punción testicular. Lo que ha sugerido que su detección implique la contraindicación de la ICSI. La heterogeneidad de las alteraciones espermatogénicas observadas en los portadores de deleciones en AZFb indican múltiples funciones de RBMY durante la espermatogénesis o bien la existencia de otros genes localizados en esta región que pueden actuar en combinación con RBMY, siendo su presencia o ausencia quien modula el fenotipo. Por todo ello, deleciones en AZFb se manifiestan frecuentemente como azoospermias, siendo las oligozoospermias severas menos frecuentes.11,18
Las deleciones en la región AZFc están asociadas tanto a azoospermias como a oligospermias severas. La histología testicular puede variar desde SCOS hasta hipoespermatogénesis y bloqueo de la maduración detenida en el estado de espermátida. La mayoría de los túbulos seminíferos poseen sólo células de Sertoli, y en algunos se observan células germinales. Es la causa molecular más clara relacionada con la esterilidad. Los daños sobre el gen DAZ no transmiten un efecto claro sobre la espermatogénesis debido a la presencia de múltiples copias del DAZ en la AZFc y en el cromosoma 3.18,22
En cualquier caso, la ausencia de DAZ parece ser insuficiente para determinar la pérdida completa de la línea espermatogénica, aunque reduce el número celular o altera su proceso de maduración. Es posible que el daño tisular causado por deleciones en DAZ sea progresivo de modo que pacientes oligozoospérmicos puedan convertirse en azoospérmicos con el tiempo. Este hecho posee una gran importancia ya que la crioconservación en estos casos, puede evitar técnicas invasivas en un futuro.11
La deleción AZFd se ha encontrado asociada con oligozoospermia o con esperma normal en números pero con anormalidades morfológicas (teratozoospermia), en general formas normales en proporción menor al 10 %.2,18
Las deleciones que afectan a más de un locus muestran fenotipos homogéneos y en general severos: azoospermias manifestadas como SCOS. Tales deleciones revelan el efecto sumatorio de cada deleción independiente. Sin embargo, microdeleciones de un único locus pueden ocasionar fenotipos heterogéneos, por lo que deleciones similares o idénticas puedan causar distintos efectos en la espermatogénesis.
No obstante, los estudios que correlacionan el tipo de deleción con el fenotipo no establecen conclusiones definitivas, dado que están basados en grupos con pocos sujetos y por lo tanto no susceptibles de someterse a análisis estadísticos. 11,18
Los defectos así detectados sugieren que conforme se alejan del centrómero las regiones del brazo largo del cromosoma Y, van interviniendo en fase más avanzadas de la maduración espermática. La AZFa en la espermatogénesis prepuberal, la AZFb en la maduración de las células germinales y la AZFc en la maduración postmeiótica. Así mismo, la probabilidad de deleción es mayor cuanto más al extremo del cromosoma se encuentre la región delecionada. De este modo la frecuencia de deleción AZFa es del 1-5 % de los varones azoospérmicos y la del AZFc es del 15 %. A mayor deleción los defectos en la espermatogénesis serán más graves, en cualquier caso la frecuencia de deleciones es mayor en pacientes azoospérmicos que en los oligospérmicos.18
Actualmente, existen varios puntos controvertidos sobre la relación entre microdeleciones del cromosoma Y y la infertilidad masculina. Solamente se detectan estos defectos en aproximadamente un 15 % de los pacientes.
Para explicar esto se han postulado varias posibilidades. La primera apunta la posibilidad de la presencia de mosaicismos por lo que la población de leucocitos en la que se realiza el estudio cromosómico fuese normal, y sin embargo, las células del tejido germinal responsable de la producción espermática si presentasen deleciones. Esto estaría también apoyado por el hecho de que entre varones gemelos univitelinos uno de ellos sea azoospérmico y el otro no.18
En el estudio realizado por Elkin Lucena y colaboradores también se incluyó un paciente portador de una deleción, donde la muestra de sangre de su padre fue negativa para la deleción, pero al analizar la muestra de semen, se encontró una deleción idéntica a la del paciente, lo que indica que el paciente heredó la deleción en Yq de su padre y que esta era de línea germinal y no somática, confirmando la presencia de mosaico de línea para la deleción.16
Otra explicación sería que las sondas de PCR utilizadas no siempre son capaces de detectar la presencia de microdeleciones, puesto que a veces estas serían muy puntuales.
En otros casos lo que ocurriría sería un defecto en la expresión de los genes responsables de la espermatogénesis.
Se debe reseñar que en algunos casos en los que se ha detectado deleciones en el cromosoma Y, no se presenta alteraciones en la producción espermática. Esto se explicaría por la presencia de copias de estos genes en otras zonas del cromosoma Y o en otros cromosomas (como el DAZ en el cromosoma 3). En otros casos, se ha comprobado como con el paso de los años se empieza a producir una disminución progresiva en el número de espermatozoides del eyaculado, lo que sugeriría una pérdida de la capacidad de expresión de las copias del gen afectado.18 Brandell describe que todo paciente infértil sin espermatozoides en su eyaculado antes fue fértil y tuvo un recuento espermático normal. Elkin Lucena y colaboradores estudiaron hombres infértiles con deleciones en el cromosoma Y y detectaron un caso que previamente fue normozoospérmico, pasó por oligozoospermia severa y, después de algunos años, llegó a ser azoospérmico (fenotipo testicular severo).16
Origen de las microdelecciones azf
Estudios familiares revelan que en la mayoría de los casos las microdeleciones en AZF son de novo. Es posible que en los padres la línea germinal sea un mosaico de tales deleciones, mientras que en sangre periférica conserven el cromosoma Y intacto. De este modo la deleción se podría transmitir a la siguiente generación, pero no se detectaría en DNA paterno. Se desconoce a qué nivel puede ocurrir la deleción, aunque los espermatocitos primarios en profase meiótica son probablemente las células más susceptibles. El mecanismo por el cual ocurre la deleción no está claro, ya que sólo determinadas regiones del cromosoma Y recombinan con el cromosoma X y ninguna recombinación ocurre en la región AZF. A pesar de ello el cromosoma Y es el cromosoma humano que espontáneamente más material genético pierde. La elevada inestabilidad del cromosoma Y se explica por el alto porcentaje de secuencias repetitivas, entre las cuales pueden darse recombinaciones intracromosómicas que causen la pérdida de material genético y por tanto la microdeleción. Así mismo, como consecuencia de reajustes complejos se pueden producir, incluso, dobles deleciones intersticiales, generándose la pérdida constante de genes o familias de genes importantes para la espermatogénesis; esto ratifica la hipótesis de que las deleciones de novo en regiones del cromosoma Yq, son frecuentes en hombres con fenotipos testiculares severos que comprometen la inestabilidad del genoma en las siguientes generaciones. Determinados factores genéticos o ambientales específicos pueden producir mayores proporciones de espermatozoides con la microdeleción de novo, que podrían competir con espermatozoides no portadores de deleciones para fertilizar al ovocito.11,16
Otro nivel en el que la deleción puede ocurrir es durante las primeras fases del desarrollo embrionario. En cualquier caso, el origen de novo de las microdeleciones AZF de varones infértiles es fundamental para establecer el papel patogénico en la pérdida de la función espermatogénica.11
No se conoce la prevalencia de las mutaciones y deleciones del AZF en la población general de varones. Aproximadamente el 2 % de varones infértiles sin otras alteraciones tienen graves defectos en la producción de esperma, y las deleciones o mutaciones de novo pueden constituir una importante proporción de estos. Por tanto en los varones con infertilidad idiopática es importante realizarles estudios citogenéticos y análisis molecular del cromosoma Y.23-26
Métodos de detección
Una vez que ha sido elaborado el mapa de marcadores de PCR del cromosoma Y, más de 300 STSs han sido físicamente localizados. Cada STS sirve como marcador de posición cromosómica, pues detecta secuencias conocidas de DNA genómico y su amplificación normal por PCR indica la presencia de esta secuencia en el cromosoma Y, mientras que la no amplificación por PCR de uno o más de estos STS en un segmento cromosómico sugiere una deleción. Un STS debe ser específico para un gen o familia de genes o puede detectar secuencias anónimas. Algunos STS pueden ser polimorfismos normales y no deben ser incluidos en un cribado de deleciones del cromosoma Y. 2,11,15
Las técnicas moleculares de STS-PCR logran amplificar las distintas regiones del cromosoma Y y se llevan a cabo a partir de DNA genómico extraído de linfocitos de sangre periférica. Los fragmentos amplificados se exponen a electroforesis y se identifican mediante tinción que puede ser de bromuro de etilo.10 Estas técnicas nos permiten identificar microdeleciones no detectadas mediante el estudio de cariotipo.16
El número de STSs empleado en el screening es variable, la Red de Calidad Europea de Genética Molecular (EMQN) intenta estandarizar los métodos de cribaje, estableciendo en 2 o 3 STSs por locus AZF los mínimos necesarios para poder detectar el 90 % de las microdeleciones del cromosoma Y. El rápido progreso de las técnicas de biología molecular nos podrán permitir en un futuro cercano mejorar la calidad y rapidez del diagnostico.11
Implicaciones clínicas
El estudio de microdeleciones en AZF puede ayudar al desarrollo de mejores métodos diagnósticos y un mayor conocimiento de la espermatogénesis. Muchos factores, incluso la mayoría de secuencias repetitivas del cromosoma Y complican la interpretación de los resultados de las microdeleciones en AZF y el estudio de genes candidatos que tienen funciones críticas en la espermatogénesis. En cualquier caso, varones con oligozoospermias severas deben ser analizados para microdeleciones en AZF, ya que si consideramos la progresión del fallo espermatogénico, varones oligozoospérmicos pueden convertirse en azoospérmicos con el tiempo. Como consecuencia, en estos casos se debe sugerir la crioconservación para evitar técnicas más invasivas en un futuro.11
La prevalencia de microdeleciones del cromosoma Y en pacientes con azoospermia no obstructiva varía de 7,8 a 21 % y en los casos con oligozoospermia es de 0 a 4,3 %. La mayoría de estos pacientes son candidatos para la realización de la inyección intracitoplasmática de espermas (ICSI) que permite la fertilización con un solo espermatozoide.2
Diferentes estudios con ICSI en pacientes con microdeleciones del cromosoma Y, revelan resultados alentadores en cuanto a la tasa de embarazo se refiere. Sin embargo, en la decisión reproductiva tomada por portadores de microdeleciones el consejo genético juega un papel importante, ya que se ha observado en estos casos un ligero incremento en el número de anormalidades cromosómicas, además de que implica la transmisión directa de tal deleción a la siguiente generación conduciendo a una esterilidad familiar.2,11,24 Esta posibilidad traería como resultado que todos los fetos masculinos fuesen portadores de la misma deleción paterna con resultado obligado de varones infértiles, siendo todas las hembras normales, lo que viene a confirmar la necesidad de realizar estudios genéticos en varones con azoospermia u oligozoospermia severa.15 Además se debería, en su momento ofrecer a los hijos de portadores de microdeleción la criopreservación de esperma dada la posibilidad del paso de oligospermia a azoospermia y poder preservar la capacidad reproductiva.18
De este modo cuando exista azoospermia no obstructiva u oligospermia severa y se detecte la presencia de deleciones del cromosoma Y, se informará a la pareja de la gran probabilidad que el origen sea genético y por tanto se pueda transmitir a la descendencia masculina.
Por todo ello, sería adecuado ofrecer un diagnóstico genético prenatal, o incluso preimplantacional, para revelar el cariotipo fetal y así descartar la posibilidad de microdeleciones del cromosoma Y.24
Aunque no hay estudios amplios relacionados con las causas genéticas de la infertilidad masculina los autores considera que el estudio de las microdeleciones del cromosoma Y pueden aportar un mayor conocimiento de la espermatogénesis.
El avance de la biología molecular permite un diagnóstico más exacto de los hombres infértiles y demuestra la importancia de las microdeleciones del cromosoma Y en la infertilidad masculina.
Existen genes específicos del cromosoma Y implicados en la infertilidad masculina que se localizan en su brazo largo y se conocen como azoospermic zone factor(AZF).
El conocimiento actual sobre la importancia de las microdeleciones del cromosoma Y en la fertilidad masculina y su diagnóstico nos puede servir para realizar un adecuado consejo genético a la pareja y su tratamiento.
Yelina Gorrita Pérez.Licenciada en Enfermería. Profesor Instructor. Máster en Atención Integral al Niño. Policlínico Universitario “Santiago Rafael Echezarreta Mulkay”. San José de las Lajas, Mayabeque, Cuba.. E-mail: remigio.gorrita@infomed.sld.cu